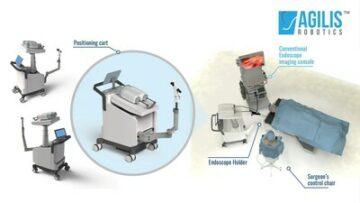
ALTSTAETTEN, Suisse, 27 juillet 2023 /PRNewswire/ — icotec, l'un des principaux fabricants de dispositifs médicaux spécialisé dans BlackArmor® Implants rachidiens en carbone/PEEK, a le plaisir d'annoncer l'obtention de l'autorisation FDA 510(k) pour son VADER® Instruments navigables du système pédiculaire. Cette réalisation représente une avancée significative dans l'amélioration de la précision chirurgicale et de la sécurité des chirurgiens de la colonne vertébrale utilisant notre BlackArmor innovant.® Implants carbone/PEEK.
Ce portefeuille élargi permet aux chirurgiens d'obtenir des résultats supérieurs pour leurs patients.
Dans le cadre de notre engagement à fournir l'expérience chirurgicale la plus sûre et la plus transparente, icotec a intégré des technologies d'assistance, telles que la navigation, dans notre instrumentation. Cette combinaison de techniques chirurgicales standard avec des capacités de navigation avancées garantit que nos procédures sont conformes aux normes de l'industrie et offrent des résultats optimaux pour nos patients.
L'ensemble de navigation nouvellement autorisé comprend une gamme complète d'instruments, à la fois pour la chirurgie ouverte et MIS. Ce portefeuille élargi offre aux chirurgiens une précision et une exactitude accrues pendant les procédures, leur permettant d'obtenir des résultats supérieurs pour leurs patients.
« Recevoir l'autorisation FDA 510(k) pour nos instruments de navigation est une réussite importante pour icotec », a déclaré Roger Stadler, PDG d'icotec, « Nous sommes fiers d'offrir à nos chirurgiens les outils dont ils ont besoin pour effectuer ces procédures avec la plus grande précision et confiance. Cette autorisation ouvre de nouvelles opportunités de croissance et réaffirme notre position de leader des implants Carbone/PEEK et notre engagement à maintenir une technique chirurgicale standard.
icotec tient à exprimer sa gratitude à toute l'équipe pour son dévouement et son travail acharné pour rendre possible ce lancement réussi. Leur engagement envers l'innovation et les soins centrés sur le patient a joué un rôle déterminant dans la réalisation de cette étape.
Pour plus d'informations sur les solutions d'implants rachidiens d'icotec, veuillez visiter notre site Web à l'adresse www.icotec-medical.com.
À propos d'icotec
icotec est un fabricant leader de dispositifs médicaux fondé en 1999 et dédié à l'avancement du domaine de l'implantation vertébrale. En mettant l'accent sur les implants en carbone/PEEK, icotec combine des technologies de pointe et une expertise industrielle pour fournir des solutions innovantes et fiables aux chirurgiens du rachis et à leurs patients. Avec un historique de succès cliniques et un engagement envers l'innovation continue, icotec est prêt à façonner l'avenir de la chirurgie de la colonne vertébrale.
![]() Voir le contenu original pour télécharger du multimédia:https://www.prnewswire.com/news-releases/icotec-ag-announces-fda-510k-clearance-for-vader-pedicle-system-navigated-instruments-advancing-precision-and-safety-in-spinal-implantation-301887188.html
Voir le contenu original pour télécharger du multimédia:https://www.prnewswire.com/news-releases/icotec-ag-announces-fda-510k-clearance-for-vader-pedicle-system-navigated-instruments-advancing-precision-and-safety-in-spinal-implantation-301887188.html
SOURCEIcotec Médical
- Contenu propulsé par le référencement et distribution de relations publiques. Soyez amplifié aujourd'hui.
- PlatoData.Network Ai générative verticale. Autonomisez-vous. Accéder ici.
- PlatoAiStream. Intelligence Web3. Connaissance Amplifiée. Accéder ici.
- PlatonESG. Automobile / VE, Carbone, Technologie propre, Énergie, Environnement, Solaire, La gestion des déchets. Accéder ici.
- Décalages de bloc. Modernisation de la propriété des compensations environnementales. Accéder ici.
- La source: https://www.biospace.com/article/releases/icotec-ag-announces-fda-510-k-clearance-for-vader-pedicle-system-navigated-instruments-advancing-precision-and-safety-in-spinal-implantation/?s=93
- :possède
- :est
- 12
- 1999
- 27
- a
- précision
- atteindre
- réalisation
- la réalisation de
- Avancée
- de suivre
- AG
- aligner
- et de
- Annoncer
- Annonce
- SONT
- AS
- At
- était
- BioEspace
- tous les deux
- capacités
- les soins
- CEO
- Infos sur les
- COM
- combinaison
- moissonneuses-batteuses
- engagement
- complet
- confiance
- contenu
- continu
- En investissant dans une technologie de pointe, les restaurants peuvent non seulement rester compétitifs dans un marché en constante évolution, mais aussi améliorer significativement l'expérience de leurs clients.
- Des technologies de pointe
- dévoué
- dédicace
- livrer
- dispositif
- download
- pendant
- responsabilise
- permet
- permettant
- améliorée
- améliorer
- Assure
- Tout
- Ether (ETH)
- étendu
- d'experience
- nous a permis de concevoir
- étendre
- fda
- champ
- Focus
- Pour
- Avant
- Fondée
- avenir
- reconnaissance
- Croissance
- Dur
- travail acharné
- HTML
- HTTPS
- in
- inclut
- industrie
- normes de l'industrie
- d'information
- Innovation
- technologie innovante
- instrumental
- instruments
- des services
- développement
- SES
- jpg
- en gardant
- lancer
- leader
- conduisant
- comme
- Fabrication
- Fabricants
- médical
- dispositif médical
- étape importante
- PLUS
- (en fait, presque toutes)
- Multimédia
- Navigation
- Besoin
- Nouveauté
- nouvellement
- of
- code
- on
- ouvert
- ouvre
- Opportunités
- optimaux
- original
- nos
- les résultats
- partie
- patients
- effectuer
- Platon
- Intelligence des données Platon
- PlatonDonnées
- veuillez cliquer
- heureux
- en équilibre
- portefeuille
- position
- possible
- La précision
- PRNewswire
- procédures
- proud
- aportando
- gamme
- réaffirme
- recevoir
- record
- fiable
- représente
- s
- plus sûre
- Sécurité
- Saïd
- fluide
- set
- Forme
- significative
- Solutions
- spécialisation
- Standard
- Normes
- étapes
- STRONG
- succès
- réussi
- tel
- haut
- #
- chirurgical
- combustion propre
- équipe
- techniques
- Les technologies
- qui
- La
- El futuro
- leur
- Les
- Ces
- l'ont
- this
- à
- les outils
- suivre
- prochain
- en utilisant
- Voir
- Visiter
- we
- Site Web
- comprenant
- activités principales
- pourra
- zéphyrnet