Il y a près d'une décennie, les mini-cerveaux ont fait leur apparition sur la scène des neurosciences avec une promesse de taille : comprendre le cerveau en développement et restaurer les cerveaux blessés.
Connus sous le nom d'organoïdes cérébraux, ces minuscules amas de tissu cérébral - à peu près de la taille d'une lentille - ne ressemblent en rien à l'organe de trois livres qui pilote nos vies. Pourtant, sous la surface, ils se comportent étrangement comme le cerveau de un fœtus humain. Leurs neurones étincellent d'activité électrique. Ils s'intègrent facilement avec—et contrôler ensuite—muscles, au moins dans un plat. Semblables à des cerveaux à part entière, ils donnent naissance à de nouveaux neurones. Certains développent même la structure à six couches du cortex humain - la couche ridée la plus externe du cerveau qui soutient la pensée, le raisonnement, le jugement, la parole et peut-être même la conscience.
Pourtant, une question cruciale hante les neuroscientifiques : ces morceaux de tissu cérébral de Frankenstein peuvent-ils réellement restaurer un cerveau blessé ?
A étude publié dans Cellule souche cellulaire ce mois-ci a conclu qu'ils le peuvent. À l'aide d'organoïdes cérébraux fabriqués à partir de cellules humaines, une équipe dirigée par le Dr Han-Chiao Isaac Chen de l'Université de Pennsylvanie a transplanté les mini-cerveaux chez des rats adultes avec des dommages importants à leur cortex visuel, la zone qui soutient la vision.
En seulement trois mois, les mini-cerveaux ont fusionné avec les cerveaux des rats. Lorsque l'équipe a allumé des lumières clignotantes pour les animaux, les organoïdes ont augmenté d'activité électrique. En d'autres termes, le mini-cerveau humain recevait des signaux des yeux des rats.
Ce n'est pas qu'un bruit aléatoire. Semblable à notre cortex visuel, certains des neurones du mini-cerveau ont progressivement développé une préférence pour la lumière émise selon une orientation particulière. Imaginez-vous en train de regarder un moulin à vent noir et blanc tandis que vos yeux s'adaptent aux différentes bandes mobiles. Cela semble simple, mais la capacité de vos yeux à s'adapter, appelée « sélection d'orientation », est un niveau sophistiqué de traitement visuel qui est essentiel à la façon dont nous percevons le monde.
L'étude est l'une des premières à montrer que le tissu du mini-cerveau peut s'intégrer à un hôte adulte blessé et remplir sa fonction prévue. Par rapport aux tentatives précédentes de greffes de cellules souches, les tissus artificiels pourraient remplacer une partie du cerveau blessée ou dégénérée à l'avenir, mais de nombreuses mises en garde demeurent.
"Les tissus neuronaux ont le potentiel de reconstruire des zones du cerveau blessé", a affirmé Valérie Plante. Chen. "Nous n'avons pas tout travaillé, mais c'est une première étape très solide."
La mini-vie d'un mini-cerveau
Les organoïdes cérébraux ont eu un sacré tour. Conçus pour la première fois en 2014, ils ont immédiatement suscité l'intérêt des neuroscientifiques en tant que modèle sans précédent du cerveau.
Les quasi-cerveaux sont fabriqués à partir de plusieurs sources pour imiter différentes zones du cerveau. Une utilisation immédiate consistait à combiner la technologie avec les iPSC (cellules souches pluripotentes induites) pour étudier les troubles neurodéveloppementaux, tels que la schizophrénie ou l'autisme.
Ici, les cellules de la peau d'un patient sont retransformées en un état semblable à une cellule souche, qui peut ensuite être cultivée dans un tissu 3D de son cerveau. Parce que la personne et le mini-cerveau partagent les mêmes gènes, il est possible de dupliquer partiellement le cerveau de la personne au cours du développement et potentiellement de rechercher de nouveaux remèdes.
Depuis leur naissance, les mini-cerveaux se sont élargis en taille, en âge et en sophistication. Un saut majeur a été un apport sanguin constant. Nos cerveaux sont intimement liés aux vaisseaux sanguins, alimentant nos neurones et nos réseaux de neurones en oxygène et en nutriments pour fournir de l'énergie. La percée a eu lieu en 2017, lorsque plusieurs équipes ont montré que la transplantation d'organoïdes humains dans des cerveaux de rongeurs incitait les vaisseaux sanguins de l'hôte à intégrer et à "nourrir" le tissu cérébral structuré, lui permettant de se développer davantage dans l'architecture cérébrale complexe à l'intérieur de l'hôte. Les études déclenché une tempête de feu de discussion dans le domaine, avec des bioéthiciens et des chercheurs se demandant si les organoïdes humains pourraient changer la perception ou le comportement d'un rongeur.
Chen avait une idée différente, quoique plus difficile. La plupart des études précédentes ont transplanté des mini-cerveaux dans les bébés rongeurs pour nourrir les organoïdes et faciliter leur fusion avec le cerveau en développement.
Les cerveaux adultes, en revanche, sont beaucoup plus striés. Des circuits neuronaux hautement entrelacés, y compris leur signalisation et leurs fonctions, sont déjà établis. Même en cas de blessure, lorsque le cerveau est prêt à être réparé, enfoncer des morceaux supplémentaires de greffes d'organoïdes humains comme un pansement pourrait soutenir les circuits neuronaux brisés ou interférer avec ceux établis.
La nouvelle étude de Chen a mis la théorie à l'épreuve.
Une fusion inattendue
Pour commencer, l'équipe a cultivé des organoïdes cérébraux avec une lignée de cellules souches humaines renouvelables. À l'aide d'une recette chimique préalablement validée, les cellules ont été transformées en mini-cerveaux qui imitent les parties frontales du cortex (autour du front).
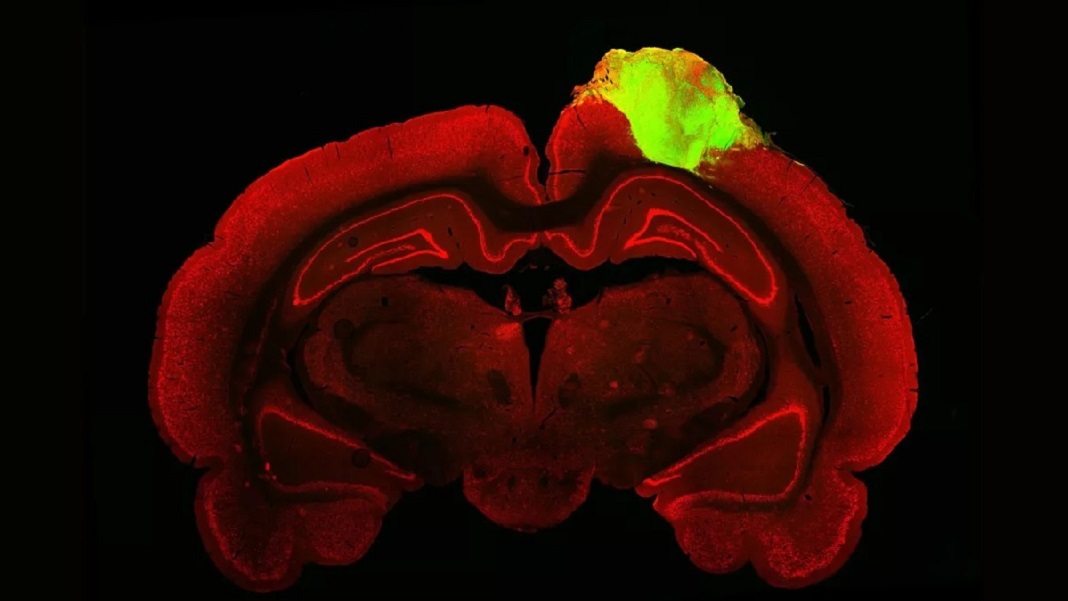
Au jour 80, l'équipe a vu des couches corticales rudimentaires dans l'organoïde, ainsi que des cellules organisées d'une manière qui ressemblait à un cerveau en développement. Ils ont ensuite transplanté les organoïdes dans le cortex visuel endommagé de jeunes rats adultes.
Un mois seulement après la greffe, les vaisseaux sanguins de l'hôte ont fusionné avec le tissu humain, lui fournissant l'oxygène et les nutriments dont il avait tant besoin et lui permettant de continuer à croître et à mûrir. Les mini-cerveaux ont développé une myriade de cellules cérébrales différentes, pas seulement des neurones, mais aussi des cellules cérébrales «de soutien» telles que les astrocytes et des cellules immunitaires spécialisées appelées microglies. Ces deux derniers sont loin d'être indispensables : ils ont été impliqués dans le vieillissement cérébral, la maladie d'Alzheimer, l'inflammation et la cognition.
Mais le mini-cerveau humain transplanté peut-il fonctionner à l'intérieur d'un rat ?
Dans un premier test, l'équipe a utilisé un traceur populaire pour cartographier les connexions entre l'organoïde et l'œil de l'animal. Semblable à un colorant, le traceur est un virus qui sautille entre les connexions neuronales – appelées synapses – tout en transportant une protéine qui brille d'un vert vif sous un microscope à fluorescence. Comme un itinéraire mis en évidence sur Google Maps, le flux lumineux était clairement connecté jusqu'au mini-cerveau transplanté, ce qui signifie que ses circuits étaient reliés, via de multiples synapses, aux yeux des rats.
Deuxième question : le tissu greffé pourrait-il aider le rat à « voir » ? Chez six animaux sur huit, allumer ou éteindre les lumières a déclenché une réponse électrique, suggérant que les neurones humains ont répondu à une stimulation extérieure. Le modèle de l'activité électrique ressemblait à ceux naturels observés dans le cortex visuel, "suggérant que les neurones organoïdes ont un potentiel de réactivité à la lumière comparable à celui des neurones du cortex visuel", ont déclaré les auteurs.
Dans un autre test, les greffes ont développé des neurones "pointilleux" qui préféraient une sélectivité d'orientation spécifique pour la lumière - une bizarrerie intégrée à notre capacité à percevoir le monde. Lorsqu'ils ont été testés avec différents réseaux de lumière qui scintillaient du noir au blanc, la préférence globale des neurones greffés imitait celle des neurones normaux et sains.
«Nous avons vu qu'un bon nombre de neurones au sein de l'organoïde répondaient à des orientations spécifiques de la lumière, ce qui nous donne la preuve que ces neurones organoïdes étaient capables non seulement de s'intégrer au système visuel, mais qu'ils étaient capables d'adopter des fonctions très spécifiques du visuel. cortex », a déclaré Chen.
Tissu cérébral prêt à l'emploi ?
L'étude montre que les mini-cerveaux peuvent rapidement établir des réseaux de neurones avec le cerveau de l'hôte, à un rythme beaucoup plus rapide que la transplantation de cellules souches individuelles. Cela suggère une utilisation puissante de la technologie : réparer les cerveaux endommagés à une vitesse sans précédent.
De nombreuses questions demeurent. D'une part, l'étude a été menée chez des rats ayant reçu des doses d'immunosuppresseurs pour inhiber le rejet. L'espoir pour les mini-cerveaux est qu'ils seront cultivés à partir des propres cellules d'un patient, éliminant ainsi le besoin de médicaments immunosuppresseurs - un espoir qui n'a pas encore été pleinement testé. Un autre problème est de savoir comment faire correspondre au mieux « l'âge » du mini-cerveau à celui de son hôte, afin de ne pas perturber les signaux neuronaux intrinsèques de la personne.
La prochaine étape de l'équipe consiste à soutenir d'autres régions cérébrales endommagées à l'aide de mini-cerveaux, en particulier les dommages dus à la dégénérescence due à l'âge ou à la maladie. L'ajout de technologies non invasives, telles que la neuromodulation ou la «réhabilitation» visuelle des neurones, pourrait aider davantage la greffe à s'intégrer dans le circuit de l'hôte et potentiellement à élever sa fonction.
"Maintenant, nous voulons comprendre comment les organoïdes pourraient être utilisés dans d'autres zones du cortex, pas seulement le cortex visuel, et nous voulons comprendre les règles qui guident la façon dont les neurones organoïdes s'intègrent au cerveau afin que nous puissions mieux contrôler ce processus et faire en sorte que cela se produise plus rapidement », a déclaré Chen.
Crédit image: Jgamadze et al.
- Contenu propulsé par le référencement et distribution de relations publiques. Soyez amplifié aujourd'hui.
- Platoblockchain. Intelligence métaverse Web3. Connaissance Amplifiée. Accéder ici.
- La source: https://singularityhub.com/2023/02/07/human-mini-brains-grafted-into-injured-rats-restored-their-sight/
- 2014
- 2017
- 3d
- a
- capacité
- Capable
- activité
- actually
- adopter
- Adulte
- Après
- anti-âge
- Tous
- Permettre
- déjà
- Alzheimer
- ainsi que
- animaux
- Une autre
- architecture
- Réservé
- domaines
- autour
- artificiel
- Tentatives
- auteurs
- Autisme
- RETOUR
- pansement
- car
- LES MEILLEURS
- Améliorée
- jusqu'à XNUMX fois
- Noir
- sang
- faire sauter
- Cerveau
- les cellules du cerveau
- cerveaux
- percée
- Brillanti
- Cassé
- la réalisation
- Cellules
- difficile
- Change
- la chimie
- chen
- clairement
- combiner
- comparable
- par rapport
- conclu
- connecté
- Connexions
- contraste
- des bactéries
- pourriez
- crédit
- critique
- journée
- décennie
- développer
- développé
- développement
- différent
- spirituelle
- Maladie
- troubles
- Perturber
- down
- doublé
- pendant
- LE NIVEAU SUPÉRIEUR
- l'élimination
- intégré
- énergie
- établir
- établies
- Pourtant, la
- peut
- preuve
- étendu
- supplémentaire
- œil
- Yeux
- plus rapide
- alimentation
- champ
- Prénom
- clignotant
- de
- d’étiquettes électroniques entièrement
- fonction
- fonctions
- plus
- Donner
- donne
- Bien
- googlemaps
- peu à peu
- Vert
- Croître
- cultivé
- guide
- arriver
- la santé
- aider
- Surbrillance
- très
- d'espérance
- houblon
- hôte
- Comment
- How To
- HTTPS
- humain
- idée
- Immédiat
- immédiatement
- in
- Dans d'autres
- individuel
- inflammation
- intégrer
- intérêt
- interférer
- intrinsèque
- IT
- couche
- poules pondeuses
- LED
- Niveau
- lumière
- Gamme
- lié
- Vit
- recherchez-
- LES PLANTES
- majeur
- faire
- de nombreuses
- Localisation
- Map
- Match
- mature
- sens
- Gratuit
- Microscope
- modèle
- Mois
- mois
- PLUS
- (en fait, presque toutes)
- en mouvement
- plusieurs
- Nature
- Nature
- Besoin
- réseaux
- Neural
- les réseaux de neurones
- Neurones
- Neuroscience
- Nouveauté
- next
- Bruit
- Ordinaire
- nombre
- ONE
- Organisé
- Autre
- au contrôle
- global
- propre
- Oxygène
- particulier
- particulièrement
- les pièces
- Patron de Couture
- Pennsylvanie
- perception
- effectuer
- personne
- pièce
- Platon
- Intelligence des données Platon
- PlatonDonnées
- Populaire
- possible
- défaillances
- l'éventualité
- solide
- préféré
- précédent
- précédemment
- Problème
- processus
- traitement
- PROMETTONS
- Protéines
- publié
- mettre
- question
- fréquemment posées
- aléatoire
- rapidement
- RAT
- Tarif
- solutions
- reçu
- recette
- régions
- rester
- Renouvelable
- réparation
- réparation
- chercheurs
- réponse
- restauration
- Rouler
- Itinéraire
- Saïd
- même
- scène
- plusieurs
- Partager
- montrer
- Spectacles
- Vue
- signaux
- similaires
- étapes
- SIX
- Taille
- Peau
- So
- solide
- quelques
- sophistiqué
- Sources
- Spark
- spécialisé
- groupe de neurones
- discours
- vitesse
- Commencer
- Région
- Potence
- Les cellules souches
- étapes
- courant
- Bandes
- structure
- structuré
- études
- Étude
- Par la suite
- Ces
- tel
- Suggère
- la quantité
- approvisionnement
- Support
- Les soutiens
- Surface
- Synapses
- combustion propre
- équipe
- équipes
- Les technologies
- Technologie
- tester
- Les
- le monde
- leur
- pensée
- trois
- Avec
- tissus
- à
- jouet
- Traceur
- transformé
- Transplantation hépatique
- déclenché
- Tournant
- sous
- comprendre
- compréhension
- Inattendu
- université
- Université de Pennsylvanie
- sans précédent
- us
- utilisé
- validé
- virus
- vision
- qui
- blanc
- dans les
- demande
- des mots
- travaillé
- world
- jeune
- Votre
- zéphyrnet