Vähihaigete ravimine ruumiliselt moduleeritud kiirguskiirtega võib hävitada kasvajad, minimeerides samas lähedalasuvate elundite ja tervete kudede kahjustusi. See on prootoni minikiirte kiiritusravi (pMBRT) idee. See on kujunemisjärgus ravimeetod, mis kasutab terapeutilise doosi edastamiseks mitmesuguseid submillimeetriseid kiirguskiire.
Minikiired koosnevad vaheldumisi suure doosiga piike ja väikese doosi orgusid – muster, mis on madalal sügavusel tervetele kudedele vähem kahjulik. Suuremal sügavusel laienevad need kiired järk-järgult, et luua homogeenne doosijaotus sihtmahu piires. Uuringud väikeste loomadega on näidanud, et pMBRT võib dramaatiliselt vähendada normaalset kudede toksilisustKoos samaväärne või parem tuumori kontroll, võrreldes tavapärase prootonteraapiaga.
"Prootoni minikiire kiiritusravi on juba näidanud prekliinilistes uuringutes märkimisväärset terapeutilise indeksi kasvu," ütleb Ramon Ortiz Alates Institut Curie. "Need paljulubavad tulemused soodustavad selle tehnika tõlkimist kliinilisse valdkonda." Sel eesmärgil hindasid Ortiz (praegu UC San Franciscos) ja kolleegid Institut Curie'st pMBRT kasulikkust vähi metastaaside ravimisel ja teatasid oma leidudest Meditsiiniline füüsika.
pMBRT stsenaariumide simuleerimine
Metastaatilised haigused põhjustavad kuni 90% vähiga seotud surmajuhtumitest. Metastaase ravitakse tavaliselt stereotaktilise kiiritusravi (SRT) tehnikatega, kuid paikseks kontrolliks vajalikku annust piirab sageli lähedalasuvate normaalsete kudede toksilisuse oht. Näiteks aju metastaaside puhul on pooltel SRT-ga ravitud patsientidest teatatud kiirgusest põhjustatud ajunekroosist.
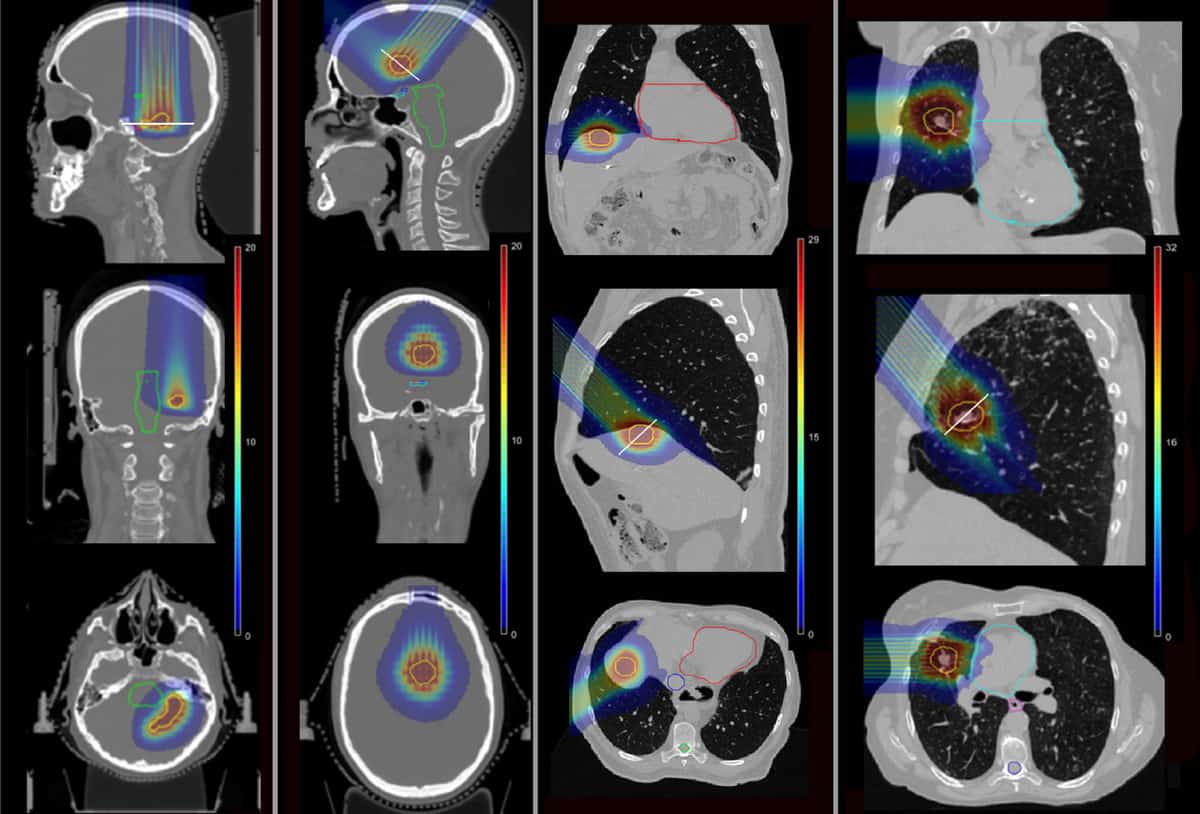
Et teha kindlaks, kas pMBRT võib selliseid tüsistusi vähendada, kasutas meeskond Monte Carlo simulatsioone, et arvutada annuste jaotus neljale patsiendile, kes said varem Institut Curie's SRT-d. Patsiente raviti metastaatiliste kahjustuste tõttu aju oimusagaras, otsmikusagaras, maksas ja kopsus.
Teadlased simuleerisid ühe fraktsiooni pMBRT plaane, kasutades ühte või kahte ravivälja, et viia kasvaja sihtmärgile sama bioloogiline ekvivalentdoos (BED), nagu SRT jaoks ette nähtud. Nad modelleerisid messingist minikiirkollimaatori, mis sisaldas 400 μm × 5.6, XNUMX cm pilusid erinevatel keskpunktide vahekaugustel, et luua nii kitsa kui ka laiema vahega minikiire. Seejärel arvutasid nad nelja patsiendijuhtumi annuste jaotused pMBRT, SRT ja tavapärase prootonravi jaoks.
Kitsa vahega pMBRT plaanides, mis loovad sihtmahus ühtlase annuse jaotuse, oli kasvaja katvus sarnane või veidi parem kui SRT plaanides. Plaanid, mis kasutasid laiema vahega pMBRT kiirteid, mis annavad sihtmärgile kvaasiühtlase annuse jaotuse, olid väiksema kasvajaga.
Oluline on see, et pMBRT vähendas oluliselt kriitiliste struktuuride annust võrreldes SRT-ga. Esimesel ajujuhtumil vähendas pMBRT keskmist BED-i riskiorganiteni (OAR) 44% (parem akustiline närv) kuni 100% (vasak akustiline närv). Teises ajuravis säästis pMBRT täielikult OAR-e, sealhulgas nägemistrakti, ajutüve ja kiasmi.
Maksa puhul vähenes maksa ja ribide keskmine BED vastavalt 25% ja 75%, vältides samal ajal ülemise õõnesveeni kiiritamist. Ja kopsujuhtumi puhul vähendati OAR-i annust 11% (ribid) kuni 100% (kopsuarter ja bronhid). Keskmine BED ja OAR-id olid pMBRT ja tavapärase prootonravi vahel enamasti sarnased.
Teadlased uurisid ka pMBRT võimalikke kahjulikke mõjusid normaalsetele kudedele. Näiteks kahe aju metastaaside juhtumi puhul arvutasid nad tervesse ajukoesse manustatud annuse. Nad arvestasid standardse fraktsioneeritud kiiritamise doosi piirmäärasid, mille puhul normaliseeritud kogudoos 2 Gy-fraktsioonide juures (NTD2.0) 72 Gy põhjustab 5% tõenäosust radionekroosi tekkeks viie aasta jooksul.
Kõigi pMBRT-plaanide puhul maksimaalne oru NTD2.0 tervele ajule (61 Gy (RBE) oimusagara puhul ja 47 Gy (RBE) otsmikusagara puhul) jäid erinevalt tavapärasest prootonteraapiast allapoole seda doosi taluvuse läve. Kopsu- ja maksametastaasidega patsientide keskmised annused kopsu- ja maksakudedele olid pMBRT plaanides samuti tunduvalt madalamad maksimaalsetest talutavatest keskmistest annustest.
Kliiniline kasu
Selles uuringus käsitletud pMBRT-ravi viidi kohale ainult ühe või kahe minikiire massiivi abil. Vähem väljade kasutamine kui SRT-ravi puhul (kolm või neli kaaret) nõuab vähem patsiendi ümberpaigutamist, vähendades fraktsiooniga raviaega, samuti vähendades väikeste annustega kokkupuutuva normaalse koe mahtu. Lisaks vähendab pMBRT manustamine ühes ravifraktsioonis märkimisväärselt kogu raviaega võrreldes SRT plaanidega, mis kasutasid kolme kuni viit fraktsiooni.

Minikiirkiirgusravi: footonitest laetud osakesteni
Teadlased juhivad tähelepanu sellele, et selles töös hinnatud pMBRT-plaane saab läbi viia kliiniliselt, kasutades Orsay prootonteraapia keskuses prekliiniliste uuringute jaoks juba rakendatud seadistust, kusjuures sihtmärgi ja elundi liikumist ravi ajal kontrollitakse nagu SRT- ja prootonteraapias.
Ortiz räägib Füüsika maailm et Institut Curie arutab nüüd I/II faasi kliiniliste uuringute võimalust. "Need hindaksid neurotoksilisuse ja kasvaja kontrolli määrasid korduva multiformse glioblastoomi ravis prootoni minikiirtega, " selgitab ta. "Selle uuringu eesmärk on aidata kaasa nende kliiniliste uuringute ettevalmistamisele."
- SEO-põhise sisu ja PR-levi. Võimenduge juba täna.
- Platoblockchain. Web3 metaversiooni intelligentsus. Täiustatud teadmised. Juurdepääs siia.
- Allikas: https://physicsworld.com/a/proton-minibeams-could-improve-treatment-of-cancer-metastases/
- 10
- a
- Kontod
- lisamine
- ebasoodne
- Eesmärgid
- Materjal: BPA ja flataatide vaba plastik
- juba
- ja
- loomad
- Array
- vältides
- taga
- alla
- Kasu
- Parem
- vahel
- Aju
- messing
- vähk
- juhul
- juhtudel
- keskus
- laetud
- kliiniline
- Kliinilistes uuringutes
- kolleegidega
- Veerud
- tavaliselt
- võrreldes
- täiesti
- Arvutama
- kaaluda
- kontrast
- aitama kaasa
- kontrollida
- kontrollitud
- tavaline
- võiks
- katmine
- looma
- kriitiline
- surmad
- tarnima
- esitatud
- edastamine
- Sügavused
- hävitama
- Määrama
- arutame
- haigus
- jaotus
- Väljamaksed
- domeen
- dramaatiliselt
- ajal
- mõju
- smirgel
- julgustama
- Samaväärne
- hindama
- hinnatud
- näide
- Selgitab
- avatud
- Valdkonnad
- esimene
- murdosa
- Francisco
- Alates
- kasu
- järk-järgult
- suurem
- Pool
- kahjulik
- tervislik
- HTTPS
- idee
- pilt
- rakendatud
- parandama
- in
- Teistes
- Kaasa arvatud
- indeks
- info
- Uuringud
- probleem
- ainult üks
- Leads
- piiratud
- piirid
- Maks
- kohalik
- Madal
- max laiuse
- maksimaalne
- minimeerimine
- liikumine
- loodus
- normaalne
- ONE
- avatud
- Muu
- välja toodud
- patsient
- patsientidel
- Muster
- faas
- Footonid
- planeerimine
- plaanid
- Platon
- Platoni andmete intelligentsus
- PlatoData
- Punkt
- võimalus
- võimalik
- varem
- tõenäosus
- paljutõotav
- Kiirgus
- Radioteraapia
- Rates
- saadud
- vähendama
- Lühendatud
- vähendab
- vähendamine
- jäi
- tähelepanuväärne
- Teatatud
- nõutav
- Vajab
- Teadlased
- vastavalt
- Tulemused
- Oht
- sama
- San
- San Francisco
- ütleb
- Teine
- madal
- näidatud
- märgatavalt
- sarnane
- väike
- standard
- uuringud
- Uuring
- selline
- parem
- sihtmärk
- meeskond
- tehnikat
- ütleb
- .
- oma
- Terapeutiline
- ravi
- kolm
- künnis
- thumbnail
- aeg
- kudede
- et
- sallivus
- Summa
- Tõlge
- ravimisel
- ravi
- uuringutes
- tõsi
- kasutama
- org
- eri
- maht
- mahud
- kas
- mis
- kuigi
- WHO
- jooksul
- Töö
- oleks
- aastat
- sephyrnet