La NMPA publicó el documento finalizado “Guía sobre diseño de estudios y análisis estadístico de dispositivos médicos en el mundo real” el 15 de enero de 2024. La versión borrador se publicó el 28 de septiembre de 2023.
Importancia de la directriz
La directriz facilitará que los fabricantes extranjeros exploren más a fondo el programa piloto de datos del mundo real de Hainan.
La Zona Piloto de Hainan Boao permite el uso en China de dispositivos médicos, IVD y medicamentos no aprobados en el extranjero, con estatus de urgencia clínica. Mientras comercializan y venden sus productos, los fabricantes pueden recopilar RWD a través de RWS en Hainan como evidencia clínica local en China para respaldar su aprobación de registro nacional NMPA. El programa especial podría acelerar su acceso al mercado chino a cuatro meses.
El gobierno de Hainan publicó el “Reglamento sobre la administración de medicamentos y dispositivos médicos importados de uso urgente en la zona piloto de turismo médico internacional de Boao Lecheng del puerto de libre comercio de Hainan”el 28 de marzo de 2023. El documento dice que NO requiere pruebas de tipo locales ni una carga de prueba significativa como la aprobación nacional.
Aspectos destacados de la directriz
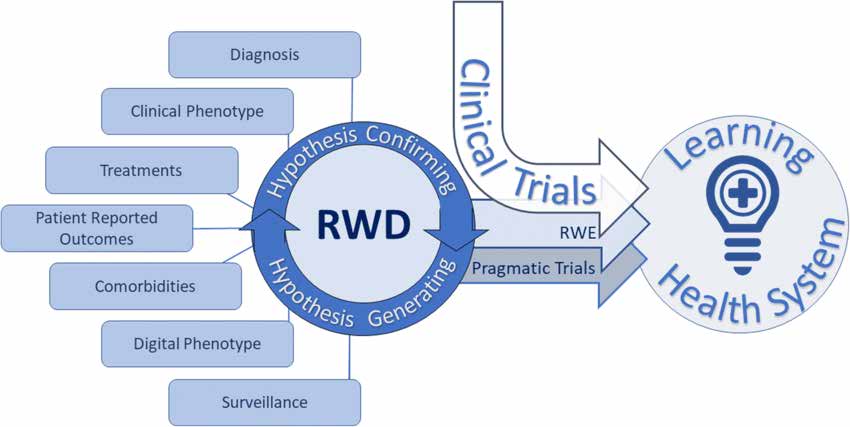
El documento sobre Diseño de estudios y análisis estadístico describe diferentes tipos de investigación del mundo real de la siguiente manera:
Los ensayos controlados aleatorios pragmáticos (pRCT) están diseñados para evaluar los resultados del tratamiento en entornos sanitarios reales. Emplean grupos de aleatorización y control para evaluar la efectividad de la intervención. Los pRCT proporcionan evidencia de alta calidad del mundo real y son adecuados para diversas poblaciones de pacientes y escenarios clínicos.
La investigación observacional del mundo real incluye varios diseños de estudio:
- Diseños de estudios descriptivos describir las características del paciente o las condiciones de salud sin inferir causalidad.
- Diseños de cohortes realizar un seguimiento de los resultados en diferentes grupos de pacientes según el uso del dispositivo, con opciones prospectivas y retrospectivas.
- Casos-controles y diseños derivados comparar pacientes con y sin uso de dispositivos e incluir estudios de casos y controles anidados y de cohortes de casos.
- Datos del mundo real como controles externos implican el uso de datos del mundo real como grupo de control, aunque faltan pautas detalladas.
El documento describe consideraciones para diseñar protocolos de investigación del mundo real:
- Antecedentes y objetivos: Definir los antecedentes de la investigación, los objetivos y las cuestiones de seguridad y eficacia en función de los datos existentes.
- Evaluación de factibilidad: Evaluar la viabilidad de realizar investigaciones en el mundo real, considerando la disponibilidad, la calidad y las variables de confusión de los datos.
- Seleccione el diseño de investigación apropiado: Elegir el diseño en función de objetivos, ya sea experimental u observacional.
- Diagrama de flujo del estudio: cree un diagrama de flujo que detalle el proceso del estudio, incluida la selección de pacientes, las intervenciones y los exámenes.
- Definir la población de estudio: Definir claramente los criterios de inclusión y exclusión de la población de estudio.
- Exposición del dispositivo: Evaluar cómo los pacientes están expuestos al dispositivo, considerando posibles sesgos.
- Grupo de control: Determinar grupos de control adecuados para estudios observacionales para equilibrar las variables de confusión.
- Medidas de resultado: Definir medidas de resultado, incluido su propósito, definición y métodos de medición.
- Recolectar Datos: Desarrollar formularios y diccionarios de recolección de datos, especificando fuentes de datos, información de calidad y métodos de vinculación.
- Ajuste por variable de confusións: Identificar variables de confusión e incluirlas/excluirlas con sus razones.
- Tiempo de seguimiento: Definir tiempos de seguimiento u observación del paciente para responder adecuadamente a las preguntas de investigación.
- Tamaño de muestra y cálculo de potencia: Calcular el tamaño de la muestra y el poder estadístico, considerando varios factores.
También destaca la importancia del Control de Calidad:
- Calidad de los Datos: Evalúe la calidad de los datos en términos de representatividad, integridad, precisión y más.
- Riesgo de sesgo: Describir medidas para controlar los riesgos de sesgo en diversas etapas, incluido el sesgo de selección, información y confusión.
- Evaluación del sesgo: Reconocer diferentes tipos de sesgos y valorar su dirección y magnitud.
- Revisión ética: Garantizar que las revisiones éticas y el consentimiento informado cumplan con las regulaciones.
Comparación de dos versiones
En comparación con la versión borrador, el documento final menciona la “Determinación de variables de confusión que necesitan modificación” en la sección Análisis estadístico.
En diseños de investigación no aleatorios del mundo real, identificar variables de confusión es crucial para controlar el sesgo. Se utilizan tres criterios para identificarlas: una variable tiene una relación causal con el resultado, está asociada a la variable de agrupación (exposición) y no es una variable intermedia en la ruta causal. Un enfoque recomendado implica un proceso de selección de variables racional basado en el conocimiento profesional y la experiencia clínica, con la colaboración de expertos clínicos y estadísticos. Para variables inciertas, se sugiere un análisis de sensibilidad, proporcionando razones y datos de respaldo para la inclusión/exclusión. Se recomienda un enfoque conservador de selección de variables, evitando variables no relacionadas y considerando cuestiones como la multicolinealidad y los efectos de interacción, visualizados a través de gráficos acíclicos dirigidos (DAG).
Para obtener una copia en inglés de la guía, envíe un correo electrónico info@ChinaMedDvice.com. Cobramos tarifas nominales por la traducción.
Consulte la últimas noticias en el programa Hainan Real World Data.
Consulte la pauta de comunicacion trabajando con las autoridades reguladoras.
Ver nuestro seminario web grabado sobre las políticas de Hainan.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- Fuente: https://chinameddevice.com/real-world-study-nmpa/
- :posee
- :es
- :no
- 15%
- 2023
- 2024
- 28
- a
- de la máquina
- la exactitud
- acíclico
- adecuadamente
- administración
- aconsejado
- permite
- también
- an
- análisis
- y
- https://www.youtube.com/watch?v=xB-eutXNUMXJtA&feature=youtu.be
- enfoque
- adecuado
- aprobación
- somos
- AS
- evaluar
- asociado
- At
- Autoridades
- disponibilidad
- evitar
- fondo
- Balance
- basado
- BE
- parcialidad
- los prejuicios
- carga
- calcular
- PUEDEN
- características
- CHARGE
- China
- Elige
- con claridad.
- Clínico
- colaboración
- recoger
- --
- COM
- cumplir
- condiciones
- conductible
- consentimiento
- Conservador
- consideraciones
- en vista de
- control
- controlado
- CONTROL
- controles
- Para crear
- criterios
- crucial
- datos
- calidad de los datos
- definir
- definición
- Derivado
- describir
- describe
- Diseño
- diseñado
- diseño
- diseños
- detallado
- detallando
- Determinar
- desarrollar
- dispositivo
- Dispositivos
- una experiencia diferente
- que dirigieron
- dirección
- diverso
- documento
- sí
- borrador
- Drogas
- eficacia
- los efectos
- enfatiza
- Inglés
- garantizar
- ético
- evaluar
- evidencia sólida
- existente
- experience
- experimental
- expertos
- explorar
- expuesto
- Exposición
- externo
- facilitar
- factores importantes
- factibilidad
- Costes
- final
- finalizado
- siguiendo
- Formularios
- Gratuito
- promover
- Gobierno
- gráficos
- Grupo procesos
- Grupo
- orientaciones
- Salud
- la salud
- alta calidad
- Cómo
- HTTPS
- Identifique
- identificar
- importancia
- in
- incluir
- incluye
- Incluye
- inclusión
- información
- informó
- interacción
- Intermedio
- Internacional
- intervención
- intervenciones
- implica
- cuestiones
- IT
- Enero
- jpg
- especialistas
- carente
- líder
- como
- local
- Fabricantes
- Marzo
- Mercado
- multiplataforma
- medidas
- servicios
- dispositivo médico
- dispositivos médicos
- menciona
- métodos
- podría
- meses
- más,
- Nacional
- ¿ Necesita ayuda
- ,
- observación
- de observación
- of
- on
- Opciones
- or
- nuestros
- Resultado
- resultados
- contornos
- de ultramar
- camino
- paciente
- los pacientes
- piloto
- Platón
- Inteligencia de datos de Platón
- PlatónDatos
- Por favor
- políticas
- población
- poblaciones
- posible
- industria
- Productos
- Profesional
- Programa
- prueba
- futuro
- protocolos
- proporcionar
- proporcionando
- publicado
- propósito
- calidad
- Preguntas
- Aleatorizado
- Racional
- real
- mundo real
- razones
- recomendado
- Registro
- reglamentos
- regulador
- relación
- liberado
- exigir
- la investigación
- Reseñas
- riesgos
- Safety
- dice
- escenarios
- Sección
- selección
- vender
- Sensibilidad
- Septiembre
- ajustes
- importante
- Tamaño
- Fuentes
- especial
- etapas
- estadístico
- Estado
- estudios
- ESTUDIO
- adecuado
- SOPORTE
- Apoyar
- términos
- Pruebas
- esa
- La
- su
- Les
- ellos
- ¿aunque?
- Tres
- A través de esta formación, el personal docente y administrativo de escuelas y universidades estará preparado para manejar los recursos disponibles que derivan de la diversidad cultural de sus estudiantes. Además, un mejor y mayor entendimiento sobre estas diferencias y similitudes culturales permitirá alcanzar los objetivos de inclusión previstos.
- veces
- a
- Turismo
- seguir
- comercio
- Traducción
- del mismo día
- ensayos
- dos
- tipo
- tipos
- Incierto
- urgencia
- urgente
- utilizan el
- usado
- usando
- variable
- diversos
- versión
- fue
- we
- sean
- mientras
- seguirá
- sin
- trabajando
- mundo
- zephyrnet