Hace casi una década, los minicerebros irrumpieron en la escena de la neurociencia con una gran promesa: comprender el cerebro en desarrollo y restaurar los cerebros lesionados.
Conocidos como organoides cerebrales, estos pequeños grupos de tejido cerebral, aproximadamente del tamaño de una lenteja, no se parecen en nada al órgano de tres libras que pilotea nuestras vidas. Sin embargo, bajo la superficie, se comportan extrañamente similar al cerebro de un feto humano. Sus neuronas chisporrotean con actividad eléctrica. Se integran fácilmente con—y posteriormente controlar—músculos, al menos en un plato. Al igual que los cerebros en toda regla, dan a luz a nuevas neuronas. Algunos incluso desarrollan la estructura de seis capas de la corteza cerebral humana: la capa más externa y arrugada del cerebro que sustenta el pensamiento, el razonamiento, el juicio, el habla y la tal vez incluso la conciencia.
Sin embargo, una pregunta crítica atormenta a los neurocientíficos: ¿pueden estos pedazos de tejido cerebral de Frankenstein realmente restaurar un cerebro lesionado?
A estudio publicado en Cell Stem Cell este mes llegó a la conclusión de que pueden. Usando organoides cerebrales hechos de células humanas, un equipo dirigido por el Dr. Han-Chiao Isaac Chen de la Universidad de Pensilvania trasplantó los mini-cerebros en ratas adultas con un daño sustancial en su corteza visual, el área que soporta la visión.
En solo tres meses, los minicerebros se fusionaron con los cerebros de las ratas. Cuando el equipo encendió luces intermitentes para los animales, los organoides se dispararon con actividad eléctrica. En otras palabras, el mini-cerebro humano recibió señales de los ojos de las ratas.
No es solo un ruido aleatorio. Al igual que nuestra corteza visual, algunas de las neuronas del mini-cerebro desarrollaron gradualmente una preferencia por la luz que brilla en una orientación particular. Imagínese mirando un juguete soplador de molino de viento en blanco y negro mientras sus ojos se adaptan a las diferentes rayas en movimiento. Suena simple, pero la capacidad de ajuste de sus ojos, denominada "selección de orientación", es un nivel sofisticado de procesamiento visual que es fundamental para la forma en que percibimos el mundo.
El estudio es uno de los primeros en mostrar que el tejido del mini-cerebro puede integrarse con un huésped adulto lesionado y realizar su función prevista. En comparación con los intentos anteriores de trasplantes de células madre, los tejidos artificiales podrían sustituir una parte lesionada o degenerada del cerebro en el futuro, pero quedan muchas advertencias.
“Los tejidos neurales tienen el potencial de reconstruir áreas del cerebro lesionado”, dijo Chen. “No hemos resuelto todo, pero este es un primer paso muy sólido”.
La minivida de un minicerebro
Los organoides cerebrales han tenido un gran viaje. Diseñados por primera vez en 2014, inmediatamente captaron el interés de los neurocientíficos como un modelo sin precedentes del cerebro.
Los cuasi-cerebros están hechos de múltiples fuentes para imitar diferentes áreas del cerebro. Un uso inmediato fue combinar la tecnología con iPSC (células madre pluripotentes inducidas) para estudiar trastornos del neurodesarrollo, como la esquizofrenia o el autismo.
Aquí, las células de la piel de un paciente se transforman de nuevo en un estado similar al de las células madre, que pueden crecer aún más hasta convertirse en un tejido 3D de su cerebro. Debido a que la persona y el mini-cerebro comparten los mismos genes, es posible duplicar parcialmente el cerebro de la persona durante el desarrollo y, potencialmente, buscar nuevas curas.
Desde su nacimiento, los minicerebros ahora se han expandido en tamaño, edad y sofisticación. Un gran salto fue un suministro constante de sangre. Nuestros cerebros están íntimamente entrelazados con los vasos sanguíneos, alimentando nuestras neuronas y redes neuronales con oxígeno y nutrientes para suministrar energía. El gran avance se produjo en 2017, cuando varios equipos demostraron que trasplantar organoides humanos en cerebros de roedores activaba los vasos sanguíneos del anfitrión para integrar y "alimentar" el tejido cerebral estructurado, lo que le permitía desarrollarse aún más en la intrincada arquitectura cerebral dentro del anfitrión. Los estudios provocó una tormenta de fuego de discusión dentro del campo, con bioéticos e investigadores por igual preguntándose si los organoides humanos podrían cambiar la percepción o el comportamiento de un roedor.
Chen tuvo una idea diferente, aunque más desafiante. La mayoría de los estudios previos trasplantaron mini-cerebros en roedores bebés para nutrir los organoides y facilitar su fusión con el cerebro en desarrollo.
Los cerebros adultos, por el contrario, son mucho más estriados. Los circuitos neuronales altamente entrelazados, incluida su señalización y funciones, ya están establecidos. Incluso cuando está lesionado, cuando el cerebro está listo para repararse, introducir pedazos adicionales de injertos de organoides humanos como una curita podría ayudar a los circuitos neuronales rotos o interferir con los establecidos.
El nuevo estudio de Chen puso a prueba la teoría.
Una fusión inesperada
Para empezar, el equipo cultivó organoides cerebrales con una línea de células madre humanas renovables. Utilizando una receta química previamente validada, las células se convirtieron en mini-cerebros que imitan las partes frontales de la corteza (alrededor de la frente).
Para el día 80, el equipo vio capas corticales rudimentarias en el organoide, junto con células organizadas de una manera que se parecía a un cerebro en desarrollo. Luego trasplantaron los organoides en la corteza visual dañada de ratas adultas jóvenes.
Solo un mes después del trasplante, los vasos sanguíneos del huésped se fusionaron con el tejido humano, proporcionándole el oxígeno y los nutrientes que tanto necesitaba y permitiéndole crecer y madurar aún más. Los minicerebros desarrollaron una miríada de células cerebrales diferentes, no solo neuronas, sino también células cerebrales de "soporte" como los astrocitos y células inmunitarias especializadas denominadas microglía. Los dos últimos están lejos de ser prescindibles: han sido implicados en el envejecimiento del cerebro, la enfermedad de Alzheimer, la inflamación y la cognición.
Pero, ¿puede el mini-cerebro humano trasplantado funcionar dentro de una rata?
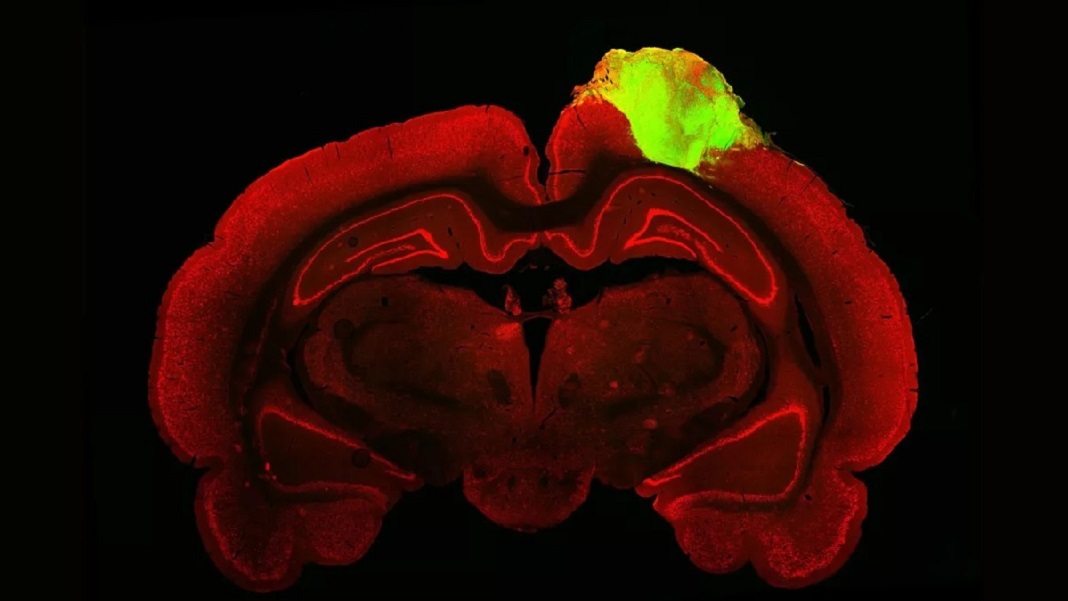
En una primera prueba, el equipo usó un marcador popular para mapear las conexiones entre el organoide y el ojo del animal. Similar a un tinte, el marcador es un virus que salta entre las conexiones neuronales, denominadas sinapsis, mientras transporta una proteína que brilla de color verde brillante bajo un microscopio fluorescente. Como una ruta destacada en Google Maps, el flujo de luz claramente se conectó hasta el mini-cerebro trasplantado, lo que significa que su circuito se conectó, a través de múltiples sinapsis, a los ojos de las ratas.
Segunda pregunta: ¿podría el tejido trasplantado ayudar a la rata a “ver”? En seis de los ocho animales, encender o apagar las luces desencadenó una respuesta eléctrica, lo que sugiere que las neuronas humanas respondieron a la estimulación externa. El patrón de la actividad eléctrica se parecía a los naturales que se observan en la corteza visual, "lo que sugiere que las neuronas organoides tienen un potencial de respuesta a la luz comparable al de las neuronas de la corteza visual", dijeron los autores.
En otra prueba, los injertos desarrollaron neuronas "quisquillosas" que preferían una selectividad de orientación específica para la luz, una peculiaridad incrustada en nuestra capacidad de percibir el mundo. Cuando se probó con diferentes rejillas de luz que parpadearon de negro a blanco, la preferencia general de las neuronas injertadas imitó la de las neuronas sanas normales.
“Vimos que una buena cantidad de neuronas dentro del organoide respondieron a orientaciones específicas de la luz, lo que nos da evidencia de que estas neuronas organoides no solo pudieron integrarse con el sistema visual, sino que también pudieron adoptar funciones muy específicas del visual. corteza”, dijo Chen.
¿Tejido cerebral plug-and-play?
El estudio muestra que los mini-cerebros pueden establecer rápidamente redes neuronales con el cerebro del huésped, a un ritmo mucho más rápido que trasplantar células madre individuales. Sugiere un uso poderoso para la tecnología: reparar cerebros dañados a una velocidad sin precedentes.
Quedan muchas preguntas. Por un lado, el estudio se realizó en ratas que recibieron dosis de inmunosupresores para inhibir el rechazo. La esperanza de los mini-cerebros es que se cultiven a partir de las propias células de un paciente, eliminando la necesidad de medicamentos inmunosupresores, una esperanza que aún no se ha probado por completo. Otro problema es cómo hacer coincidir mejor la "edad" del mini-cerebro con la de su anfitrión, para no interrumpir las señales neuronales intrínsecas de la persona.
El próximo paso del equipo es ayudar a otras regiones cerebrales dañadas usando mini-cerebros, particularmente el daño debido a la degeneración por la edad o la enfermedad. Agregar tecnologías no invasivas, como la neuromodulación o la "rehabilitación" visual de las neuronas, podría ayudar aún más a que el trasplante se integre en el circuito del huésped y, potencialmente, eleve su función.
“Ahora, queremos entender cómo se podrían usar los organoides en otras áreas de la corteza, no solo en la corteza visual, y queremos entender las reglas que guían cómo las neuronas organoides se integran con el cerebro para que podamos controlar mejor ese proceso y hacer que suceda más rápido”, dijo Chen.
Crédito de la imagen: Jgamadze et al.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- Platoblockchain. Inteligencia del Metaverso Web3. Conocimiento amplificado. Accede Aquí.
- Fuente: https://singularityhub.com/2023/02/07/human-mini-brains-grafted-into-injured-rats-restored-their-sight/
- 2014
- 2017
- 3d
- a
- capacidad
- Poder
- actividad
- adoptar
- Adulto
- Después
- Aging
- Todos
- Permitir
- ya haya utilizado
- Alzheimer
- y
- animales
- Otra
- arquitectura
- Reservada
- áreas
- en torno a
- artificial
- Los intentos
- Autorzy
- Autismo
- Atrás
- Tirita
- porque
- MEJOR
- mejores
- entre
- Negro
- sangre
- volar
- Cerebro
- células del cerebro
- sesos
- ruptura
- Brillante
- Roto
- .
- Células
- desafiante
- el cambio
- químico
- chen
- con claridad.
- combinar
- comparable
- en comparación con
- Concluido
- conectado
- Conexiones
- contraste
- control
- podría
- crédito
- crítico
- día
- década
- desarrollar
- desarrollado
- el desarrollo
- una experiencia diferente
- discusión
- Enfermedades
- trastornos
- Interrumpir
- DE INSCRIPCIÓN
- doblado
- durante
- ELEVATE
- eliminando
- integrado
- energía
- establecer
- se establece
- Incluso
- todo
- evidencia sólida
- expandido
- extra
- ojos
- Ojos
- más rápida
- alimentación
- campo
- Nombre
- intermitente
- en
- completamente
- función
- funciones
- promover
- Donar
- da
- candidato
- Google Maps
- gradualmente
- Verde
- Crecer
- crecido
- guía
- suceder
- saludable
- ayuda
- Destacado
- altamente
- esperanza
- saltos
- fortaleza
- Cómo
- Como Hacer
- HTTPS
- humana
- idea
- inmediata
- inmediatamente
- in
- En otra
- INSTRUMENTO individual
- inflamación
- integrar
- intereses
- interferir
- intrínseco
- IT
- .
- ponedoras
- LED
- Nivel
- luz
- línea
- vinculado
- Vidas
- mirando
- hecho
- gran
- para lograr
- muchos
- mapa
- Mapas
- Match
- un estudiante adulto
- sentido
- Fusión
- Microscopio
- modelo
- Mes
- meses
- más,
- MEJOR DE TU
- emocionante
- múltiples
- Natural
- Naturaleza
- ¿ Necesita ayuda
- telecomunicaciones
- Neural
- redes neuronales
- Neuronas
- Neurociencia
- Nuevo
- Next
- ruido
- normal
- número
- ONE
- Organizado
- Otro
- afuera
- total
- EL DESARROLLADOR
- Oxígeno
- particular
- particularmente
- partes
- Patrón de Costura
- Pennsylvania
- percepción
- realizar
- persona
- pieza
- Platón
- Inteligencia de datos de Platón
- PlatónDatos
- Popular
- posible
- posible
- la posibilidad
- poderoso
- preferido
- anterior
- previamente
- Problema
- tratamiento
- PROMETEMOS
- Proteínas
- publicado
- poner
- pregunta
- Preguntas
- azar
- rápidamente
- RATA
- Rate
- ready
- recibido
- recetas
- regiones
- permanecer
- Renovables
- reparación
- reparación
- investigadores
- respuesta
- restauración
- VIAJE
- Ruta
- reglas
- Said
- mismo
- escena
- Varios
- Compartir
- Mostrar
- Shows
- Visión
- señales
- similares
- sencillos
- SEIS
- Tamaño
- Piel
- So
- sólido
- algo
- sofisticado
- Fuentes
- Spark
- especializado
- soluciones y
- habla
- velocidad
- comienzo
- Estado
- Potencias
- células madre
- paso
- stream
- Rayas
- estructura
- estructurado
- estudios
- ESTUDIO
- Después
- sustancial
- tal
- Sugiere
- suministro
- abastecimiento
- SOPORTE
- soportes
- Superficie
- Sinapsis
- te
- equipo
- equipos
- Tecnologías
- Tecnología
- test
- El
- el mundo
- su
- pensamiento
- Tres
- A través de esta formación, el personal docente y administrativo de escuelas y universidades estará preparado para manejar los recursos disponibles que derivan de la diversidad cultural de sus estudiantes. Además, un mejor y mayor entendimiento sobre estas diferencias y similitudes culturales permitirá alcanzar los objetivos de inclusión previstos.
- tejidos
- a
- juguete
- Trazador
- transformado
- Trasplantes
- desencadenados
- Turning
- bajo
- entender
- comprensión
- Inesperado
- universidad
- Universidad de Pensilvania
- sin precedentes
- us
- utilizan el
- validado
- virus
- visión
- que
- complejo de salvador blanco
- dentro de
- preguntando
- palabras
- trabajado
- mundo
- joven
- tú
- zephyrnet