Behandling af cancerpatienter med rumligt modulerede strålingsstråler kan ødelægge tumorer, samtidig med at skader på nærliggende organer og sundt væv minimeres. Det er ideen bag proton ministråle-strålebehandling (pMBRT), en ny behandlingsteknik, der bruger en række submillimeter-størrelsesstråler til at levere terapeutisk dosis.
Ministrålerne omfatter alternerende højdosistoppe og lavdosisdale, et mønster, der er mindre skadeligt for sundt væv på lave dybder. På større dybder udvides disse stråler gradvist for at skabe en homogen dosisfordeling inden for målvolumenet. Undersøgelser i små dyr har vist, at pMBRT kan dramatisk reducere normal vævstoksicitet, med tilsvarende eller overlegen tumorkontrolsammenlignet med konventionel protonterapi.
"Proton ministrålebehandling har allerede vist en bemærkelsesværdig gevinst i det terapeutiske indeks i prækliniske undersøgelser," siger Ramon Ortiz fra Institut Curie. "Disse lovende resultater tilskynder til oversættelse af denne teknik til det kliniske domæne." Med dette formål evaluerede Ortiz (nu ved UC San Francisco) og kolleger ved Institut Curie fordelene ved pMBRT til behandling af cancermetastaser, rapporterede deres resultater i Medicinsk fysik.
Simulering af pMBRT-scenarier
Metastatisk sygdom tegner sig for op til 90 % af kræftrelaterede dødsfald. Metastaser behandles almindeligvis med stereotaktisk strålebehandling (SRT), men den dosis, der kræves til lokal kontrol, er ofte begrænset af risikoen for toksicitet for nærliggende normalt væv. For hjernemetastaser, for eksempel, rapporteres strålingsinduceret hjernenekrose hos halvdelen af patienter behandlet med SRT.
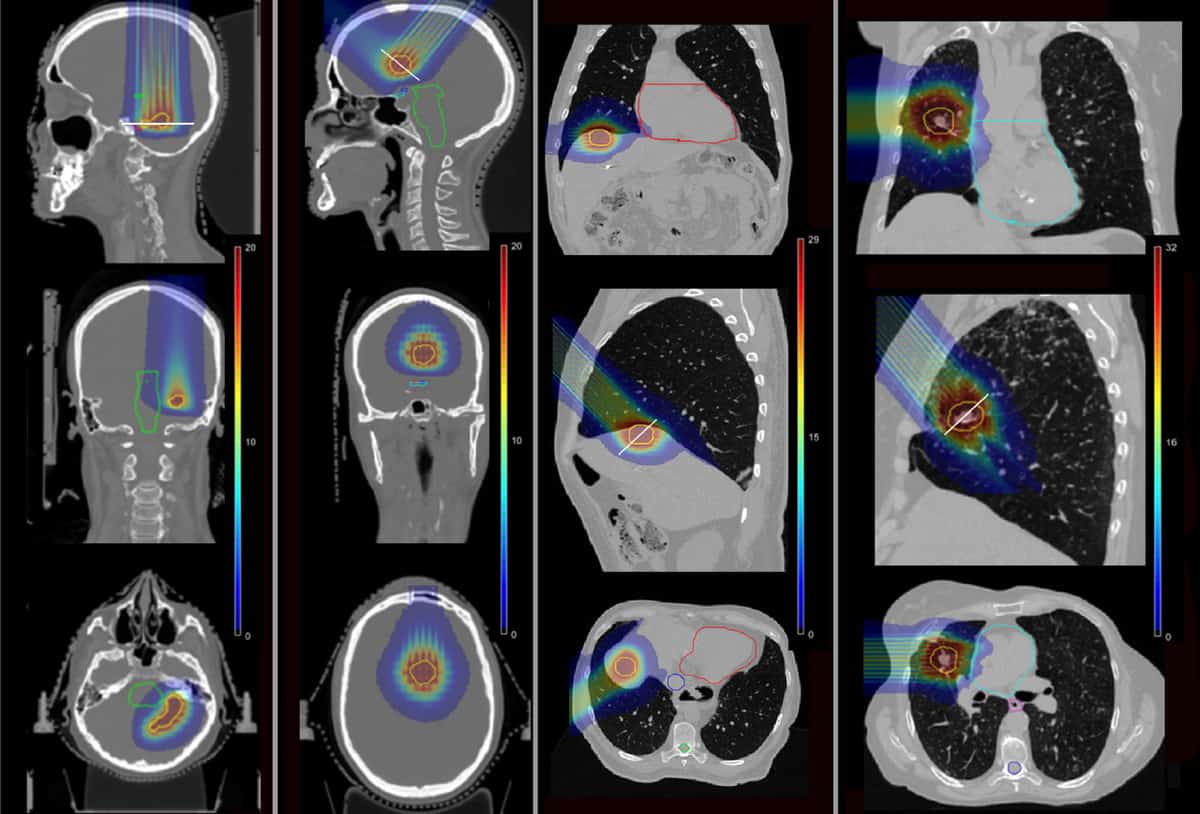
For at afgøre, om pMBRT kan reducere sådanne komplikationer, brugte holdet Monte Carlo-simuleringer til at beregne dosisfordelinger for fire patienter, der tidligere modtog SRT på Institut Curie. Patienterne var blevet behandlet for metastatiske læsioner i hjernens tindingelap, frontallappen, leveren og lungen.
Forskerne simulerede single-fraktion pMBRT-planer ved at bruge et eller to behandlingsfelter til at levere den samme biologiske ækvivalente dosis (BED) til tumormålet som foreskrevet for SRT. De modellerede en messing ministråle kollimator indeholdende 400 μm × 5.6 cm slidser ved forskellige center-til-center-adskillelser for at skabe både smalle og bredere afstande ministråler. De beregnede derefter dosisfordelinger for de fire patienttilfælde, for pMBRT, SRT og konventionel protonterapi.
I de snævre afstande pMBRT-planer, som skaber en ensartet dosisfordeling i målvolumenet, var tumordækningen lig med eller lidt bedre end i SRT-planerne. Planer, der anvender pMBRT-stråler med bredere afstand, som leverer en kvasi-ensartet dosisfordeling til målet, havde en lavere tumordækning.
Det er vigtigt, at pMBRT reducerede dosis signifikant til kritiske strukturer sammenlignet med SRT. I det første hjernetilfælde reducerede pMBRT den gennemsnitlige BED til risikoorganer (OARs) med mellem 44 % (højre akustisk nerve) og 100 % (venstre akustisk nerve). I den anden hjernebehandling skånede pMBRT fuldstændigt OAR'erne, inklusive den optiske trakt, hjernestammen og chiasme.
I levertilfældet blev den gennemsnitlige BED til leveren og ribbenene reduceret med henholdsvis 25 % og 75 %, samtidig med at man undgår bestråling af vena cava superior. Og for lungetilfældet blev dosis til OAR reduceret med mellem 11 % (ribben) og 100 % (lungearterien og bronkierne). Den gennemsnitlige BED til OARs var for det meste ens mellem pMBRT og konventionel protonterapi.
Forskerne undersøgte også mulige negative virkninger af pMBRT på normalt væv. For de to tilfælde af hjernemetastaser beregnede de for eksempel den dosis, der blev leveret til sundt hjernevæv. De overvejede dosisgrænserne for standard fraktioneret bestråling, hvor en normaliseret total dosis ved 2 Gy-fraktioner (NTD)2.0) på 72 Gy fører til en 5 % sandsynlighed for radionekrose inden for fem år.
For alle pMBRT-planer er den maksimale dal NTD2.0 til den raske hjerne (61 Gy(RBE) for temporallappen og 47 Gy(RBE) for frontallappen) forblev under denne dosistolerancetærskel, i modsætning til konventionel protonterapi. For patienter med lunge- og levermetastaser var middeldoserne til lunge- og levervæv i pMBRT-planer også et godt stykke under de maksimalt tolerable middeldoser.
Kliniske fordele
De pMBRT-behandlinger, der overvejes i denne undersøgelse, blev leveret ved hjælp af kun en eller to ministråle-arrays. Brugen af færre felter end i SRT-behandlingerne (tre eller fire buer) kræver mindre patientrepositionering, hvilket reducerer fraktionsbehandlingstiden samt sænker volumen af normalt væv udsat for lave doser. Derudover reducerer levering af pMBRT i én behandlingsfraktion betydeligt den samlede behandlingstid sammenlignet med SRT-planerne, som brugte tre til fem fraktioner.

Ministrålebehandling: fra fotoner til ladede partikler
Forskerne påpeger, at de pMBRT-planer, der blev evalueret i dette arbejde, kunne leveres klinisk ved hjælp af det set-up, der allerede er implementeret på Orsay Proton Therapy Center til prækliniske forsøg, med mål- og organbevægelser under behandlingen kontrolleret som i SRT og protonterapi.
Ortiz fortæller Fysik verden at Institut Curie nu diskuterer muligheden for fase I/II kliniske forsøg. "Disse ville evaluere neurotoksicitet og tumorkontrolhastigheder i behandlingen af tilbagevendende glioblastoma multiforme med proton ministråler," forklarer han. "Denne undersøgelse har til formål at bidrage til forberedelsen af disse kliniske undersøgelser."
- SEO Powered Content & PR Distribution. Bliv forstærket i dag.
- Platoblokkæde. Web3 Metaverse Intelligence. Viden forstærket. Adgang her.
- Kilde: https://physicsworld.com/a/proton-minibeams-could-improve-treatment-of-cancer-metastases/
- 10
- a
- Konti
- Desuden
- negativ
- målsætninger
- Alle
- allerede
- ,
- dyr
- Array
- undgå
- bag
- jf. nedenstående
- fordele
- Bedre
- mellem
- Brain
- messing
- Kræft
- tilfælde
- tilfælde
- center
- opladet
- Klinisk
- kliniske forsøg
- kolleger
- Kolonner
- almindeligt
- sammenlignet
- fuldstændig
- Compute
- betragtes
- kontrast
- bidrage
- kontrol
- kontrolleret
- konventionelle
- kunne
- dækning
- skabe
- kritisk
- dødsfald
- levere
- leveret
- leverer
- Dybder
- ødelægge
- Bestem
- diskuterer
- Sygdom
- fordeling
- Distributioner
- domæne
- dramatisk
- i løbet af
- effekter
- smergel
- tilskynde
- Ækvivalent
- evaluere
- evalueret
- eksempel
- Forklarer
- udsat
- Fields
- Fornavn
- fraktion
- Francisco
- fra
- Gevinst
- gradvist
- større
- Halvdelen
- skadelig
- sund
- HTTPS
- idé
- billede
- implementeret
- Forbedre
- in
- I andre
- Herunder
- indeks
- oplysninger
- Undersøgelser
- spørgsmål
- bare en
- Leads
- Limited
- grænser
- Lever
- lokale
- Lav
- max-bredde
- maksimal
- minimering
- bevægelse
- Natur
- normal
- ONE
- åbent
- Andet
- skitseret
- patient
- patienter
- Mønster
- fase
- Fotoner
- planlægning
- planer
- plato
- Platon Data Intelligence
- PlatoData
- Punkt
- Muligheden
- mulig
- tidligere
- sandsynlighed
- lovende
- Stråling
- Strålebehandling
- priser
- modtaget
- reducere
- Reduceret
- reducerer
- reducere
- forblevet
- bemærkelsesværdig
- rapporteret
- påkrævet
- Kræver
- forskere
- henholdsvis
- Resultater
- Risiko
- samme
- San
- San Francisco
- siger
- Anden
- lavvandet
- vist
- betydeligt
- lignende
- lille
- standard
- undersøgelser
- Studere
- sådan
- overlegen
- mål
- hold
- teknikker
- fortæller
- deres
- Terapeutisk
- terapi
- tre
- tærskel
- thumbnail
- tid
- væv
- til
- tolerance
- I alt
- Oversættelse
- behandling
- behandling
- forsøg
- sand
- brug
- Dal
- forskellige
- bind
- mængder
- hvorvidt
- som
- mens
- WHO
- inden for
- Arbejde
- ville
- år
- zephyrnet