Behandling af kræft med stråling kan stimulere kroppens immunrespons og hæmme tumorvækst, men det kan også reducere niveauet af lymfocytter, de hvide blodlegemer forbundet med immunrespons, hvilket resulterer i nedsat tumorkontrol og dårlig prognose. Sværhedsgraden af denne strålingsinducerede lymfopeni korrelerer med den dosis, der leveres til cirkulerende blodceller og lymfocytter. Som sådan kan minimering af dosis til hjertet, perifert blod og lymfoide organer hjælpe med at reducere denne skadelige effekt.
For at undersøge denne teori nærmere har Antje Galts og Abdelkhalek Hammi fra TU Dortmund University undersøgte, om FLASH-strålebehandling - stråling leveret ved ultrahøje dosishastigheder - kunne reducere niveauet af immuncelleudtømning under protonbehandling af hjernekræftpatienter.
"Den biologiske mekanisme bag den observerede FLASH-besparende effekt ved høje dosishastigheder er endnu ikke fuldt ud forstået. En af de foreslåede teorier er imidlertid immunhypotesen, som antyder, at den øjeblikkelige dosislevering af FLASH-bestråling signifikant reducerer udtømningen af cirkulerende lymfocytter ved at minimere eksponeringstiden,” forklarer Hammi. "I vores undersøgelse viste vi, at en hypofraktioneret behandling og hurtig dosislevering skånede immunceller med op til 27 gange sammenlignet med en konventionel fraktioneret proton blyantstråle scanning behandlingsplan."
Galts og Hammi brugte en dosimetrisk blodgennemstrømningsmodel at simulere dosis til cirkulerende lymfocytter under konventionel og FLASH-baseret intensitetsmoduleret protonterapi (IMPT) af en hjernetumor. Den dynamiske stråleleveringsmodel simulerer en IMPT fraktioneret behandlingsplan, mens den rumlige tidsvariation af dosishastigheden for hver enkelt protonblyantstråle tages i betragtning. Hammi bemærker, at modellen inkorporerer realistiske leveringsparametre fra kommercielt tilgængelige cyklotroner.
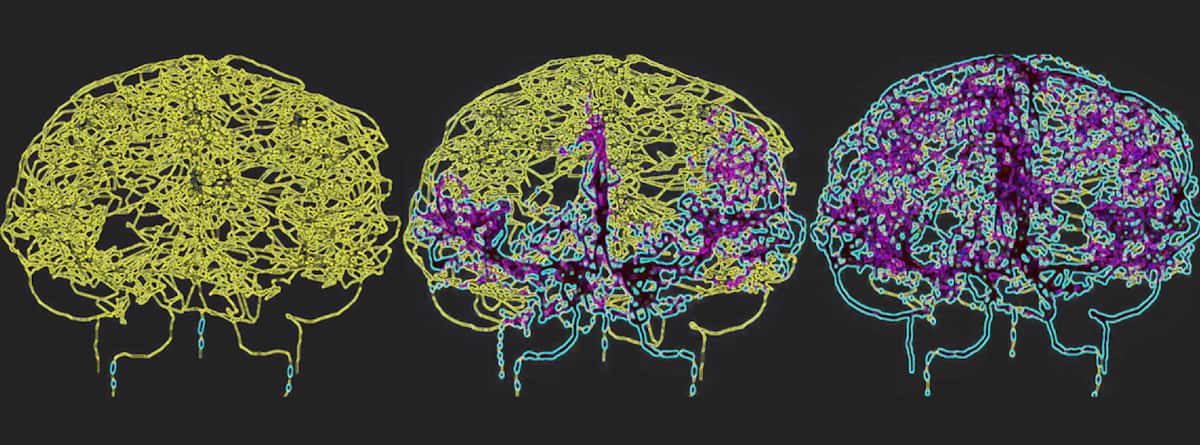
For nøjagtigt at afspejle blodcirkulationen i den menneskelige hjerne, kortlagde Galts og Hammi blodkar direkte fra hjerne-MR-angiografibilleder. De brugte den resulterende cerebrovaskulære model, som omfattede 465 blodkar og 8841 individuelle kargrene, til at simulere cirkulationen af immunceller i blodstrømmen.
Forskerne lavede realistiske IMPT-behandlingsplaner for en glioblastomtumor ved hjælp af fire indfaldende protonstråler og klinisk relevante leveringsparametre. De beregnede derefter de tidsvarierende strålingsfelter, som det cirkulerende blod udsættes for under levering af protonterapiplanerne og den akkumulerede dosis efter behandlingen, og rapporterede deres resultater i Fysik i medicin og biologi.
Glioblastom er den mest dødelige form for hjernekræft, og behandling med strålebehandling kan forårsage langvarig strålingsinduceret lymfopeni. "Ved at modellere et cerebrovaskulært system under strålingslevering håber vi at få dybere indsigt i, hvordan strålebehandling påvirker immunresponset i disse grupper af patienter, hvilket potentielt kan føre til forbedrede terapeutiske strategier," siger Hammi.
Plan sammenligninger
Galts og Hammi undersøgte fire behandlingsscenarier: IMPT FLASH med en enkelt 22.3 Gy fraktion; hypofraktioneret FLASH under anvendelse af to 14.6 Gy og fem 8 Gy fraktioner; og konventionel IMPT under anvendelse af toogtredive 2 Gy fraktioner. For hver behandlingsplan vurderede de den dosimetriske indvirkning på de cirkulerende lymfocytter og estimerede den resulterende radiotoksicitet.
Dosis-volumen histogrammer afslørede, at FLASH-strålebehandling signifikant reducerede andelen af bestrålede celler sammenlignet med konventionel dosishastighed IMPT. Under den første behandlingsfraktion bestrålede alle tre FLASH-skemaer omkring 1.52 % af det cirkulerende blodvolumen, mens konventionel IMPT bestrålede 2.18 %. Hypofraktionerede FLASH-planer, leveret over to eller fem fraktioner, øgede dette bestrålede volumen til henholdsvis 3.01 % og 7.35 %, mens konventionel IMPT udsatte 42.41 % af det perifere blod for stråling.
Dernæst undersøgte forskerne niveauet af cirkulerende lymfocytter, der fik en dosis på mindst 7 cGy - en tærskel, der forårsager 2% udtømning i lymfocytpopulationen - under hele behandlingen. Efter at have gennemført konventionel IMPT modtog 25.65 % af de cirkulerende lymfocytter en dosis på mindst 7 cGy. For enkelt-, to- og fem-fraktioner FLASH-behandlinger var de volumener, der modtog mere end denne dosistærskel, henholdsvis 1.21 %, 2.30 % og 5.14 %.
Volumenet af cirkulerende lymfocytter, der modtog doser på mere end 100 cGy, hvilket forårsager 30 % udtømning, var 0.77 %, 1.28 % og 2.09 % for henholdsvis enkelt-, to- og femfraktioner FLASH og 0.10 % under konventionel IMPT.
Galts og Hammi undersøgte også responsen af CD4+ og CD8+ lymfocytter, som har forskellige fordelinger i perifert blod, på de forskellige bestrålingsscenarier. For begge lymfocyttyper var celledrab efter den første fraktion henholdsvis 0.66%, 0.62%, 0.32% og 0.08% for enkelt-, to- og fem-fraktioner FLASH og konventionel IMPT.
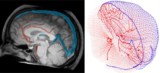
Beregningsmodel bestemmer dosis til blod under strålebehandling
Efter den fulde behandling var udtømningen i lymfocytter 1.02 % og 1.56 % for henholdsvis to- og fem-behandlingsfraktioner og 2.14 % for konventionel IMPT. Disse resultater viser, at FLASH-protonterapi skåner cirkulerende immunceller under intrakraniel behandling, med en enkelt fraktion af FLASH, der reducerer udtømningsraten med næsten 70 % sammenlignet med konventionel IMPT.
Hammi fortæller Fysik verden at de nu udvider modellen til også at omfatte hoved-halskræft. "Ydermere undersøger vi forskellige FLASH-leveringsmetoder og deres indvirkning på nedbrydningen af immunsystemet, med et særligt fokus på konform FLASH-behandling, der er baseret på passiv, patientspecifik energimodulation," forklarer han. "Denne leveringsmodel har potentiale til at skåne flere cirkulerende lymfocytter sammenlignet med shoot-through FLASH levering."
- SEO Powered Content & PR Distribution. Bliv forstærket i dag.
- PlatoData.Network Vertical Generative Ai. Styrk dig selv. Adgang her.
- PlatoAiStream. Web3 intelligens. Viden forstærket. Adgang her.
- PlatoESG. Kulstof, CleanTech, Energi, Miljø, Solenergi, Affaldshåndtering. Adgang her.
- PlatoHealth. Bioteknologiske og kliniske forsøgs intelligens. Adgang her.
- Kilde: https://physicsworld.com/a/flash-irradiation-spares-immune-cells-during-proton-therapy/
- :har
- :er
- :ikke
- $OP
- 1
- 10
- 100
- 14
- 160
- 2%
- 22
- 25
- 27
- 35 %
- 7
- 73
- 8
- a
- Akkumuleret
- præcist
- Efter
- Alle
- næsten
- også
- an
- ,
- ER
- omkring
- AS
- vurderes
- forbundet
- At
- til rådighed
- baseret
- Beam
- bag
- blod
- blodårer
- både
- Brain
- hjernekræft
- grene
- men
- by
- beregnet
- CAN
- Kræft
- kræftpatienter
- kræft
- Årsag
- årsager
- celle
- Celler
- cirkulerende
- Circulation
- klik
- klinisk
- kommercielt
- sammenlignet
- færdiggøre
- Overvejer
- kontrol
- konventionelle
- kunne
- oprettet
- dybere
- leveret
- levering
- leveringsmetoder
- demonstrere
- bestemmer
- skadelig
- forskellige
- direkte
- fordeling
- Distributioner
- dosis
- doser
- i løbet af
- dynamisk
- hver
- effekt
- energi
- Hele
- lige
- Equilibrium
- anslået
- Ether (ETH)
- ekspanderende
- Forklarer
- udforsket
- Udforskning
- udsat
- Eksponering
- FAST
- Fields
- fund
- Fornavn
- fem
- Blink
- flow
- Fokus
- efter
- Til
- formular
- fire
- fraktion
- fra
- fuld
- fuldt ud
- yderligere
- Gevinst
- Gruppens
- Vækst
- Have
- he
- Hjerte
- hjælpe
- Høj
- håber
- Hvordan
- Men
- HTTPS
- menneskelig
- billede
- billeder
- immun
- Immunsystemet
- KIMOs Succeshistorier
- forbedret
- SKAT
- in
- hændelse
- omfatter
- medtaget
- inkorporerer
- øget
- individuel
- oplysninger
- indsigt
- ind
- undersøge
- spørgsmål
- IT
- jpg
- drab
- førende
- mindst
- til venstre
- Niveau
- længere
- max-bredde
- mekanisme
- medicin
- metoder
- minimering
- model
- modellering
- modellering
- mere
- mest
- mr
- Noter
- nu
- observeret
- of
- on
- ONE
- åbent
- or
- vores
- ud
- i løbet af
- parametre
- særlig
- passive
- patienter
- perifere
- Fysik
- Fysik verden
- fly
- planer
- plato
- Platon Data Intelligence
- PlatoData
- fattige
- befolkning
- potentiale
- potentielt
- formering
- andel
- foreslog
- Stråling
- Strålebehandling
- Sats
- priser
- realistisk
- modtaget
- modtagende
- reducere
- Reduceret
- reducerer
- reducere
- afspejler
- relevant
- Rapportering
- forskere
- henholdsvis
- svar
- resulterer
- Revealed
- højre
- s
- siger
- scanning
- scenarier
- ordninger
- sværhedsgrad
- viste
- betydeligt
- enkelt
- starte
- stimulere
- strategier
- strøm
- studeret
- Studere
- sådan
- foreslår
- systemet
- fortæller
- end
- at
- deres
- derefter
- teori
- Terapeutisk
- terapi
- Disse
- de
- denne
- tre
- tærskel
- Gennem
- thumbnail
- tid
- gange
- til
- behandling
- behandling
- behandlinger
- sand
- tumor
- to
- typer
- forstået
- universitet
- anvendte
- ved brug af
- forskellige
- Beholder
- fartøjer
- bind
- mængder
- var
- we
- var
- hvornår
- hvorvidt
- som
- mens
- hvid
- med
- inden for
- world
- gul
- endnu
- zephyrnet